Reaksi Subtitusi Aromatik Kedua dan Ketiga Serta Kaitan Dengan Persamaan Hammet
Reaksi
substitusi adalah
bentuk reaksi kimia,
di mana suatu atom dalam senyawa kimia digantikan dengan atom lainnya. Reaksi substitusi adalah salah satu
reaksi yang penting dalam kimia organik. Reaksi substitusi dalam kimia organik dikelompokkan sebagai elektrofilik atau nukleofilik bergantung padareagen yang digunakan, apakah suatu zat
antara yang reaktif terlibat dalam reaksi tersebut adalah suatu karbokation,
suatu karbanion atau suatu radikal bebas atau apakah substratnya merupakan suatu alifatikatau aromatik.
Pemahaman mendetail mengenai jenis reaksi mampu membantu untuk memprediksi
produk yang dihasilkan dari reaksi tersebut. Pemahaman ini juga berguna untuk
mengoptimasi suatu reaksi dengan mempetimbangkan variabel seperti suhu dan
pemilihan pelarut.
Mekanisme reaksi substitusi nukleofilik pada dasarnya terdapat dua mekanisme reaksi
substitusi nukleofilik yaitu SN1 dan SN2. Berikut
ini adalah ciri-ciri suatu reaksi yang berjalan melalui mekanisme SN1:
- Kecapatan reaksinya tidak tergantung pada konsentrasi nukleofil. Tahap penentu kecepatan reaksi adalah tahap pertama di mana nukleofil tidak terlibat.
- Jika karbon pembawa gugus pergi adalah bersifat kiral, reaksi menyebabkan hilangnya aktivitas optik karena terjadi rasemik. Pada ion karbonium, hanya ada a gugus yang terikat pada karbon positif. Karena itu, karbon positif mempunyai hibridisasi sp2 dan berbentuk planar. Jadi nukleofil mempunyai dua arah penyerangan, yaitu dari depan dan dari belakang. Dan kesempatan ini masing-masing mempunyai peluang 50 %. Jadi hasilnya adalah rasemit. Misalnya, reaksi (S)-3-bromo-3-metilheksana dengan air menghasilkan alkohol rasemik.
X yang melalui mekanisme SN1 akan
berlangsung cepat jika R merupakan struktur tersier, dan lambat jika R adalah
struktur primer. Hal ini sesuai dengan urutan kestabilan ion karbonium, 3o-Spesies
antaranya (intermediate species) adalah ion karbonium dengan geometrik planar
sehingga air mempunyai peluang menyerang dari dua sisi (depan dan belakang)
dengan peluang yang sama menghasilkan adalah campuran rasemik Reaksi substrat R
> 2o >> 1o.
Adapun ciri reaksi SN2 adalah:
- Karena nukleofil dan substrat terlibat dalam langkah penentu kecepatan reaksi, maka kecepatan reaksi tergantung pada konsentrasi kedua spesies tersebut.
- Reaksi terjadi dengan pembalikan (inversi) konfigurasi. Misalnya jika kita mereaksikan (R)-2-bromobutana dengan natrium hidroksida, akan diperoleh (S)-2-butanol.Ion hidroksida menyerang dari belakang ikatan C-Br. Pada saat substitusi terjadi, ketiga gugus yang terikat pada karbon sp3 kiral itu seolah-olah terdorong oleh suatu bidang datar sehingga membalik. Karena dalam molekul ini OH mempunyai perioritas yang sama dengan Br, tentu hasilnya adalah (S)-2-butanol. Jadi reaksi SN2 memberikan hasil inversi.
- Jika substrat R-L bereaksi melalui mekanisme SN2, reaksi terjadi lebih cepat apabila R merupakan gugus metil atau primer, dan lambat jika R adalah gugus tersier. Gugus R sekunder mempunyai kecepatan pertengahan. Alasan untuk urutan ini adalah adanya efek rintangan sterik. Rintangan sterik gugus R meningkat dari metil < primer < sekunder < tersier. Jadi kecenderungan reaksi SN2 terjadi pada alkil halida adalah: metil > primer > sekunder >> tersier.
Alkilasi
Alkilasi Friedel-Crafts melibatkan alkilasi dari cincin aromatik dan alkil halida menggunakan katalis asam Lewis. Dengan menggunakan feri klorida sebagai katalis, gugus alkil melekat pada posisi ion klorida sebelumnya.
Reaksi ini memiliki beberapa kerugian, di antaranya adalah produk reaksi ini lebih nukleofilik dari reaktan reaksi dikarenakan pendonor elektron rantai alkil. Oleh karena ini, hidrogen yang lainnya tersubstitusikan oleh rantai alkil lainnya, menghasilkan molekul yang kelebihan gugus alkil. Jika atom klorin tidak berada dalam karbon tersier, reaksi penataan-ulang akan terjadi. Ini dikarenakan stabilitas karbokation tersier yang lebih stabil dari karbokation sekunder maupun primer.
Rintangan sterik dapat digunakan untuk membatasi banyaknya alkilasi yang terjadi seperti pada t-butilasi 1,4-dimetoksibenzena.
Alkilasi tidak hanya terbatas pada alkil halida: reaksi Friedel-Crafts dapat terjadi pada seluruh zat antara karbokation seperti zat antara dari reaksi alkena dengan asam protik ataupun asam Lewis. Dalam satu kajian, elektrofilnya adalah ion bromonium yang diturunkan dari alkena dan NBS:
Dalam reaksi ini, samarium(III) triflat dipercaya mengaktfkan pendonor NBS halogen pada formasi ion halonium.
Dealkilasi
Alkilasi Friedel-Crafts adalah reaksi reversibel. Pada reaksi dealkilasi Friedel-Crafts, gugus alkil dapat dilepas jika terdapat proton dan asam Lewis.
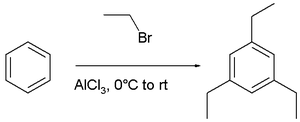
Sebagai contoh, pada adisi bromoetana pada benzena, substitusi orto dan para diharapkan terjadi pada tahap substitusi yang pertama karena gugus alkil termasuk dalam gugus aktivasi. Namun hasil produk reaksi yang sebenarnya adalah 1,3,5-trietilbenzena dengan seluruh gugus alkilnya berada pada posisi meta. Kontrol reaksi termodinamika menyebabkan substitusi meta lebih difavoritkan daripada substitusi orto dan para yang melalui reaksi kesetimbangan kimia. Oleh karena itu, hasil paling akhir reaksi ini disebabkan oleh rentetan reaksi alkilasi dan dealkilasi.
A.
Subtituen
Kedua
Benzena
yang telah tersubstitusi dapat mengalami substitusi kedua. Gugus (substituen)
pertama dapat mempengaruhi kereaktifan (laju reaksi) dan posisi substituen pada
substitusi kedua. Contoh :
1.
Substitusi kedua pada anilin oleh Br2 berlangsung cepat
tanpa katalis daripada benzena.
2.
Substitusi kedua pada nitrobenzena harus dengan katalis, temperatur tinggi, dan
waktu yang lebih lama daripada benzena.
Beberapa
substituen pertama sebagai pengarah, substituen kedua pada posisi orto dan
para, serta beberapa substituen pertama sebagai pengarah pada posisi meta.
Pengarah orto-para
Gugus pada cincin akan mengarahkan substituen
yang baru masuk pada posisi orto, para atau meta sesuai dengan gugus mulanya.
Gugus mula tersebut yang disebut sebagai penentu orientasi. Gugus yang
merupakan activator kuat adalah gugus pengarah orto, para (adisi elektrofilik
mengambil tempat pada posisi orto dan para bergantung pada activator).
Orientasi ini terutama disebabkan oleh kemampuan substituen pengaktif kuat
untuk melepaskan elektron (gugus amino dan gugus hidoksil merupakan gugus
activator yang baik).
Berikut
ini nama gugus pada pengarah orto-para :
Contohnya
aniline
Pengarah meta
Subtituen
penarik electron akan mengdeaktivasi cincin terhadapt E+. Suatu pengarah meta mempunyai atom bermuatan
positif atau sebagian positif yang terikat pada cincin benzena. Dalam reaksi
nitrobenzena, gugus nitronya tidak menambah kesetabilan intermedietnya. Malahan
intermediet substitusi orto, atau para dan keadaan transisinya kurang stabil
(karena energy yang tinggi), karena sebuah struktur resonansi mengandung muatan
positif pada atom berdekatan. Oleh karena itu, substitusi terjadi lebih banyak
pada tempat meta, sebab keadaan transisi dan intermediatnya pada tempat yang
berdekatan mengandung muatan positif.
Berikut ini efek
substituen pertama terhadap substituen kedua:
B.
Subtituen Ketiga
1. Jika 2 subtituen mengarahkan 1 gugus
masuk ke posisi 1 maka menjadi posisi utama dari subtitusi ke 3
2. Jika 2 gugus bertentangan dalam
efek-efek pengarahnya maka aktivatornya lebih kuat
Jika 2 gugus pada cincin berposisi meta
satu sama lain tidak menjalani subtitusi pada posisi yang diapit, meskipun
mungkin teraktif pada posisi itu
Efek Subtituen Terhadap Reaktivitas
Substituen
tidak saja mempengaruhi posisi substitusi, tetapi juga mempengaruhi laju
substitusi, yaitu apakah akan berlangsung lebih lambat atau lebih cepat
dibandingkan benzena. Suatu substituen dianggap sebagai pengaktif (activating)
jika lajunya lebih cepat dan pendeaktif (deactivating) jika lajunya lebih
lambat.
Dalam semua gugus
pengarah meta, atom yang berhubungan dengan cincin membawa muatan positif penuh
atau parsial dan dengan demikian akan menarik elektron dari cincin. Semua
pengarah meta dengan demikian juga merupakan gugus pendeaktif cincin.
Sebaliknya, gugus pengarah oto para pada umumnya memasok elektron ke cincin dan
dengan demikian merupakan pengaktif cincin. Akan halnya halogen (F, Cl, Br, dan
I), kedua efek yang berlawanan ini, mengakibatkan pengecualian penting pada
aturan tersebut. Karena bersifat sebagai penarik elektron kuat, halogen
merupakan pendeaktif cincin, namun karena adanya pasangan elektron bebas, maka
halogen adalah pengarah orto para.
PERTANYAAN
1) Mengapa
gugus hidroksil lebih bersifat pendonor electron?
2) Mengapa
orto lebih stabil dibandingkan meta dan para?
DAFTAR PUSTAKA
Fessenden.
1986. Kimia Organik Jilid
I. Jakarta
: Erlangga.















Hai Dyah. menurut saya
BalasHapus1. hal ini dikarenakan pada gugus hidroksil terdapat atom O yang memiliki 2 pasangan elektron bebas yang cenderung akan mendonorkan elektronnya
2. orto lebih stabil daripada para dan meta dalam hal apa ?? kalau untuk kasus substitusi kedua misalnya. Biasanya itu tergantung lagi pada substituen pertamanya. Kalau substituen pertamanya adalah gugus pengarah orto dan para, maka benar posisi orto dan para akan lebih stabil dimana akan terbentuk intermediet karbokation yang lebih stabil dikarenakan letak muatan positifnya pada karbon tersier dan dapat distabilisasi oleh efek induktif elektron-donor pada gugus metil.
Terimakasih.
Materi yang sangat menarik, saya akn menjawab pertanyaan nomor 1 dimna pada gugus hidroksil memiliki PEB yg dpt didonorkan guna utk menstabilkan suatu reaksi pada posisi orto-para.
BalasHapusTerima kasih atas materinya
BalasHapusMenurut saya karena O pada hidroksil memiliki PEB yg dapat menyumbangkan elektronnya
Materi yang menarik dyah, menurut saya gugus hidroksil (-OH) memiliki pasangan elektron menyendiri pada atom oksigennya, sehingga OH cenderung bersifat sebagai pendonor elektron. Kestabilan posisi substituen tergantung dari jenis substituennya, apabila substituennya aktivator, maka posisi orto dan para akan lebih stabil dibandingkan meta. jika substituennya deaktivator, maka posisi meta akan lebih stabil dibandingkan orto dan para
BalasHapusTerimakasih dyah
BalasHapusUntuk pertanyaannya
1. Hidroksil memiliki atom O yang memiliki PEB sehingga dapat disumbangkan (sebagai pendonor elektron) pada cincin benzena
2. Kestabilan dipengaruhi oleh substituen pertama yang mana gugus pendorong elektron stabil memang pada orto dan para namun tidak berlaku pada penarik elektron yang stabilnya pada posisi meta
sekian :)
Terimakasih penjelasannya dyah, sangat bermanfaat
BalasHapusBaiklah disini saya akan menjawan pertanyaan yang diajukan
Gugus hidroksil (-OH) memiliki pasangan elektron menyendiri pada atom oksigennya, sehingga OH cenderung bersifat sebagai pendonor elektron. Kestabilan posisi substituen tergantung dari jenis substituennya, apabila substituennya aktivator, maka posisi orto dan para akan lebih stabil dibandingkan meta. jika substituennya deaktivator, maka posisi meta akan lebih stabil dibandingkan orto dan para
Terimakasih :)
terimakasih atas materinya disini untuk pertanyaan pertama O yang memiliki 2 pasangan elektron bebas yang cenderung akan mendonorkan elektronnya sehingga lebih mngarah pada donor elektron
BalasHapusterima kasih atas materinya, menurut saya gugus hindroksil sebagai pendorong karena memiliki 2 PEB dari atom oksigen yang didonorkan kepada akseptor
BalasHapusOh memilik pasangan elektron bebas, shingga sepasang elektron dr hidroksil dapt berikatanr angkl dg benzen. Akibatnya satubitan pi terdekat pada cincin yaitu c1 dam c2 putus dan sepasang elektron bebas terdapat pada c2 yaitubtepat pada posisi orto
BalasHapusSaya akn menjawab no 1 menurut saya gugus OH menjadi pendonor elektron karna memiliki PEB
BalasHapus